45. Химический потенциал
45. Химический потенциал
Химической энергией называется такая энергия, которая образуется в результате химических взаимодействий и входит в состав внутренней энергии вещества. Химические реакции делятся на экзотермические (проходящие с выделением энергии) и эндотермические (сопровождающиеся ее поглощением).
В случае химической реакции меняется внутренняя энергия системы, так как меняется поглощение атомов в веществах-реагентах. Для таких процессов, можно применить первое начало термодинамики в виде:
U1-U2 =?U=Q+A,
где Q– количество теплоты;
DU – изменение внутренней энергии вещества;
А – полезная работа, включающая работу по преодолению также различных электромагнитных сил.
Работа, совершенная в процессе обратимой химической реакции, является максимальной. Ее выражают с помощью уравнения Гиббса-Гельмгольца:
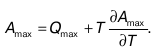
Рассмотрим химический потенциал реакции. В случае химических реакций масса реагирующих веществ не постоянна, ее можно определить в виде функции т (количество вещества) от основных параметров (v, p, T, F, S, Uи т. д). Продифференцируем равенство:
U = mu,
где u– удельное количество внутренней энергии, имеем:
dU = mdu + udm,
ф = u– ST+ pv = i– ST
j– химический потенциал.
Но, химическим потенциалом называется частная производная по массе, взятая от какого-либо термодинамического потенциала при определенных значениях аргумента. Химический потенциал показывает, как меняется энергия вещества, если его масса изменяется на единицу.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Химический снаряд
Химический снаряд «С утра этого ясного весеннего дня было тепло, – легкий юго-западный ветер чуть шевелил ветки деревьев.Прикрытая спереди лесом, в мелкой поросли притаилась батарея. Замаскированные орудия сами казались кустами.Ровно в шесть часов на батарее услышали
4. Химический состав древесины
4. Химический состав древесины Химический состав древесины зависит частично от ее состояния. Древесина свежесрубленных деревьев содержит много воды. Но в абсолютно сухом состоянии древесина состоит из органических веществ, а неорганическая часть составляет всего лишь
18. Потенциал скорости и ускорение при ламинарном движении
18. Потенциал скорости и ускорение при ламинарном движении ? = ?(x, y, z) (1)Функция ? называется потенциалом скорости.С учетом этого, компоненты ? выглядят следующим образом: Формулой (1) описывается неустановившееся движение, поскольку она содержит параметр t.Ускорение при
Химический шифр наследственности
Химический шифр наследственности Если вам когда-нибудь скажут, что у кошки вместо котят родились щенята, а у лошади — слоненок, вы улыбнетесь и, конечно, не поверите такому чуду. И будете правы. Жизнь приучила нас к тому, что орел — от орла, а не от страуса. Ио не часто мы
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ Вопрос 413. Какой персонал осуществляет организацию водно-химического режима работы оборудования и его контроль?Ответ. Осуществляет подготовленный персонал химической лаборатории или
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ 12.1. Организовать водно-химический режим с целью обеспечения надежной работы тепловых энергоустановок, трубопроводов и другого оборудования без повреждения и снижения экономичности, вызванных
49. Химический состав, методы получения порошков, свойства и методы их контроля
49. Химический состав, методы получения порошков, свойства и методы их контроля Порошковые материалы – материалы, получаемые в результате прессования металлических порошков в изделия необходимой формы и размеров и последующего спекания сформованных изделий в вакууме
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ
12. ВОДОПОДГОТОВКА И ВОДНО-ХИМИЧЕСКИЙ РЕЖИМ ТЕПЛОВЫХ ЭНЕРГОУСТАНОВОК И СЕТЕЙ 12.1. Организовать водно-химический режим с целью обеспечения надежной работы тепловых энергоустановок, трубопроводов и другого оборудования без повреждения и снижения экономичности, вызванных