42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова
42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова
Универсальное уравнение, описывающее состояние любых реальных газов, было получено в 1939 г. русскими учеными И. И. Новиковым и М. Н. Вукаловичем. В нем
уже учитывалось явление силового взаимодействия молекул (ассоциация, диссоциация) и в общей форме оно записывалось в виде:
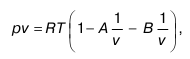
где А и В– коэффициенты, вычисляемые по формулам:
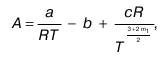
где а и b – для реальных газов постоянные величины в уравнениях состояния;
R – универсальная газовая постоянная; r, c, k, m1, m2 – коэффициенты, выражающие степень ассоциации.
Иначе уравнение Вукаловича-Новикова можно представить в виде:
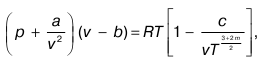
где а и b – постоянные величины в уравнении Ван-дер-Ваальса; m, c – постоянные, рассчитываемые опытным путем.
В общем случае основными для перегретого пара (аналогично газу) являются такие параметры состояния, как температура, давление и удельный объем. Перегретый пар близок по свойствам к идеальному газу, так как его параметры расположены далеко от критической точки и от пограничной кривой (верхняя кривая на диаграммах). Если давление перегретого пара не очень велико, то его уравнение состояния можно получить, используя уравнение Ван-дер-Ваальса для случая реального газа, путем введения в него поправок.
Для водяного пара уравнение состояния М. Н. Вукаловича и И. И. Новикова в современной термодинамике является наиболее точным уравнением. Причем его можно использовать и для расчета состояний перегретого пара (при условии и для расчета давления), если добавить к нему несколько последующих членов уравнения.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
2.5. Кое-что о реальных иерархиях
2.5. Кое-что о реальных иерархиях До сих пор наши выводы были чисто умозрительны. Как они подтверждаются реальным строением нервной системы животных и что можно сказать о понятиях промежуточных уровней иерархии, реально складывающейся в процессе эволюции?При сравнении
19. Уравнение неразрывности жидкости
19. Уравнение неразрывности жидкости Довольно часто при решении задач приходится определять неизвестные функции типа:1) р = р (х, у, z, t) – давление;2) nx(х, у, z, t), ny(х, у, z, t), nz(х, у, z, t) – проекции скорости на оси координат х, у, z;3) ? (х, у, z, t) – плотность жидкости.Эти неизвестные,
23. Уравнение Эйлера для разных состояний
23. Уравнение Эйлера для разных состояний Уравнение Эйлера для разных состояний имеет разные формы записи. Поскольку само уравнение получено для общего случая, то рассмотрим несколько случаев:1) движение неустановившееся. 2) жидкость в покое. Следовательно, Ux = Uy = Uz = 0.В
25. Уравнение Бернулли
25. Уравнение Бернулли Уравнение Громеки подходит для описания движения жидкости, если компоненты функции движения содержат какуююто вихревую величину. Например, эта вихревая величина содержится в компонентах ?x, ?y,?z угловой скорости w.Условием того, что движение
33. Уравнение Бернулли для движения вязкой жидкости
33. Уравнение Бернулли для движения вязкой жидкости Элементарная струйка при установившемся движении вязкой жидкостиУравнение для этого случая имеет вид (приводим его без вывода, поскольку его вывод сопряжен с применением некоторых операций, приведение которых
35. Уравнение Бернулли для неустановившегося движения вязкой жидкости
35. Уравнение Бернулли для неустановившегося движения вязкой жидкости Для того, чтобы получить уравнение Бернулли, придется определить его для элементарной струйки при неустановившемся движении вязкой жидкости, а затем распространять его на весь потокПрежде всего,
25. Уравнение состояния идеального газа
25. Уравнение состояния идеального газа Уравнение состояния идеального газа описывает связь между его температурой и давлением. Поскольку давление идеального газа в замкнутой системе P = 1/3 О mn<v2>, P= nkT, то уравнение идеального газа будет выглядеть следующим образом:P =
26. Универсальное уравнение состояния идеального газа
26. Универсальное уравнение состояния идеального газа Отношение массы mгаза (вещества) к количеству газа (вещества) vэтой системы называют молярной массой газа (вещества):М = m/ v.Размерность молярной массы следующая: [M] = 1 кг / 1 моль.Следствие из закона Авогадро позволяет
28. Средняя молярная масса смеси газов
28. Средняя молярная масса смеси газов Уравнение для нахождения удельной газовой постоянной смеси:R = еgiRi= 8314,2(g1/ M1+ g2/ M2+… + gn/ Mn)Зная молярную массу смеси, можно найти газовую постоянную смеси:R = 8,314 / M.Зная объемный состав смеси, получим следующие формулы:gi= (R / Ri),еgi = Rе(ri / Ri) =
41. Уравнение состояния Ван-дер-Ваальса
41. Уравнение состояния Ван-дер-Ваальса В общем случае для реальных газов при вычислении параметров состояния нельзя использовать уравнение состояния pv = RT,которое верно для идеальных газов.Общее уравнение состояния для реальных газов. в котором коэффициенты Bi –
48. Уравнение неразрывности
48. Уравнение неразрывности Согласно газовой теории потока течение газа в случае стационарности определяется с помощью специальной системы уравнений. В нее входят следующие соотношения:1) уравнение энергии для газового потока;2) уравнение состояния;3) уравнение для
55. Дросселирование газа и уравнение процесса
55. Дросселирование газа и уравнение процесса Для водяного пара критическая температура составляет Тк = 647 К, соответственно, Тинв > 4400 К (температура инверсии). В процессе дросселирования всегда происходит охлаждение водяного пара, это связано с полной диссоциацией
10.5. Влияние газов на свойства серебряных сплавов
10.5. Влияние газов на свойства серебряных сплавов Серебро не очень активно взаимодействует с различными газами, за исключением кислорода. Так, азот не растворяется ни в жидком, ни в твердом серебре. Ничтожна растворимость инертных газов в серебре. Растворимость водорода в
11.5. Влияние газов на свойства сплавов золота
11.5. Влияние газов на свойства сплавов золота Встречающиеся при плавке газы, такие как кислород, водород, углеводороды, азот, моно– и диоксид углерода, сернистый газ, пары воды, образующиеся при попадании водорода в кислородосодержащий раствор, и т. п., ни в твердом, ни в
Повышенная токсичность выхлопных газов
Повышенная токсичность выхлопных газов Состав и количество токсичных компонентов в отработавших газах двигателя, зависят главным образом от его технического состояния, все прочие факторы изложены ниже.Содержание СО и СН в отработавших газах автомобиля определять при