48. Уравнение неразрывности
48. Уравнение неразрывности
Согласно газовой теории потока течение газа в случае стационарности определяется с помощью специальной системы уравнений. В нее входят следующие соотношения:
1) уравнение энергии для газового потока;
2) уравнение состояния;
3) уравнение для неразрывности газового потока.
Уравнение энергии следует из первого начала
термодинамики для газовых потоков.
Уравнением неразрывности называется соотношение:
Gv = Fw.
Из него следует, что в случае установившегося течения газа в каждом сечении потока расход газа по массе является постоянной величиной. Иначе это уравнение можно записать в виде:
G =pFw =p1F1w1 =P2F2w2 =const,
где r1,r2, r= 1/v плотность газа в поперечных сечениях;
F1, F2– площадь сечения потока;
w1, w2– скорость потока, измеряется в области сечения.
В данном случае имеется два сечения потока (1-е и 2-е), а величина Gиз этого уравнения называется массовым расходом газа (в секунду).
Как известно, второй закон Ньютона гласит: «Сила определяется произведением массы и ускорения». Если газовый поток имеет одномерный характер, то из второго закона следует:
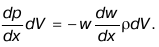
В данном соотношении каждый член имеет определенное физическое значение. Рассмотрим каждый множитель из уравнения.
1. Величина
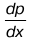
показывает, как изменяется давление в зависимости от Х-координаты.
2. Величина
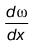
показывает, как изменяется скорость в зависимости от Х-координаты.
3. Соотношение
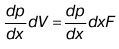
равно силе, приложенной к элементарному объему, dV – выделенный объем.
dw
4. Величина
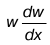
газа равна ускорению массы pdV(элементарная масса).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
19. Уравнение неразрывности жидкости
19. Уравнение неразрывности жидкости Довольно часто при решении задач приходится определять неизвестные функции типа:1) р = р (х, у, z, t) – давление;2) nx(х, у, z, t), ny(х, у, z, t), nz(х, у, z, t) – проекции скорости на оси координат х, у, z;3) ? (х, у, z, t) – плотность жидкости.Эти неизвестные,
23. Уравнение Эйлера для разных состояний
23. Уравнение Эйлера для разных состояний Уравнение Эйлера для разных состояний имеет разные формы записи. Поскольку само уравнение получено для общего случая, то рассмотрим несколько случаев:1) движение неустановившееся. 2) жидкость в покое. Следовательно, Ux = Uy = Uz = 0.В
25. Уравнение Бернулли
25. Уравнение Бернулли Уравнение Громеки подходит для описания движения жидкости, если компоненты функции движения содержат какуююто вихревую величину. Например, эта вихревая величина содержится в компонентах ?x, ?y,?z угловой скорости w.Условием того, что движение
33. Уравнение Бернулли для движения вязкой жидкости
33. Уравнение Бернулли для движения вязкой жидкости Элементарная струйка при установившемся движении вязкой жидкостиУравнение для этого случая имеет вид (приводим его без вывода, поскольку его вывод сопряжен с применением некоторых операций, приведение которых
35. Уравнение Бернулли для неустановившегося движения вязкой жидкости
35. Уравнение Бернулли для неустановившегося движения вязкой жидкости Для того, чтобы получить уравнение Бернулли, придется определить его для элементарной струйки при неустановившемся движении вязкой жидкости, а затем распространять его на весь потокПрежде всего,
25. Уравнение состояния идеального газа
25. Уравнение состояния идеального газа Уравнение состояния идеального газа описывает связь между его температурой и давлением. Поскольку давление идеального газа в замкнутой системе P = 1/3 О mn<v2>, P= nkT, то уравнение идеального газа будет выглядеть следующим образом:P =
26. Универсальное уравнение состояния идеального газа
26. Универсальное уравнение состояния идеального газа Отношение массы mгаза (вещества) к количеству газа (вещества) vэтой системы называют молярной массой газа (вещества):М = m/ v.Размерность молярной массы следующая: [M] = 1 кг / 1 моль.Следствие из закона Авогадро позволяет
41. Уравнение состояния Ван-дер-Ваальса
41. Уравнение состояния Ван-дер-Ваальса В общем случае для реальных газов при вычислении параметров состояния нельзя использовать уравнение состояния pv = RT,которое верно для идеальных газов.Общее уравнение состояния для реальных газов. в котором коэффициенты Bi –
42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова
42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова Универсальное уравнение, описывающее состояние любых реальных газов, было получено в 1939 г. русскими учеными И. И. Новиковым и М. Н. Вукаловичем. В немуже учитывалось явление силового взаимодействия
55. Дросселирование газа и уравнение процесса
55. Дросселирование газа и уравнение процесса Для водяного пара критическая температура составляет Тк = 647 К, соответственно, Тинв > 4400 К (температура инверсии). В процессе дросселирования всегда происходит охлаждение водяного пара, это связано с полной диссоциацией