Глава 2 Внутри клетки
В предыдущей главе мы говорили о революционных потрясениях в биологии, благодаря которым создалась возможность все более глубокого и полного изучения живых организмов при все возрастающей степени разрешения. Мы говорили о целом организме. Затем — о клетке и, наконец, обратились к химическим реакциям, протекающим внутри клетки, сравнив их с производственными процессами на фабрике.
Далее мы сказали, что молекулярная биология исследует главным образом работу клетки на молекулярном уровне и при этом вскользь упомянули два наиболее важных вида молекул, являющихся компонентами клетки, а именно молекулы белков и молекулы нуклеиновых кислот. Мы указали, что и те, и другие представляют собой молекулы-гиганты, состоящие из тысяч атомов, тогда как обычные молекулы, с которыми привыкли работать химики, содержат не более нескольких десятков атомов. Мы отметили, что именно такие гигантские молекулы играют в биологических системах наиболее важную роль.
Фактически секрет возникновения, существования и значения молекулярной биологи кроется в появлении возможности изучать эти гигантские молекулы, не подвластные старым химическим методам.
Три следующие главы будут посвящены белкам. Пытаясь представить, как выглядит молекула белка, мы будем вынуждены перейти на язык химических формул и молекулярных моделей, причем это будут достаточно сложные формулы и модели — речь ведь идет об очень сложных молекулах. Поэтому сначала мы попытаемся выяснить, что означают те формулы и модели, которыми пользуются химики.
Формулы — это всего лишь символы. Когда вы смотрите на формулу вещества, вы видите не само вещество, а только его символ — своего рода абстракцию реального объекта. Но опытному глазу химика она кое-что говорит. Она как бы заставляет звенеть звоночки в его мозгу, и чем опытней химик, тем больше таких звоночков будет звенеть.
Возьмем, к примеру, формулу воды Н2O — едва ли не самую простую и всем известную формулу. Что она означает? Она говорит нам, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Химик, глядя на эту формулу, сразу же представляет себе, что атомы молекулы воды расположены так, что угол между направлениями связей Н — О и О — Н должен быть около 105°, а расстояния между атомами водорода и кислородом составляют по 0,96 ? 10-8 см — чуть менее одной стомиллионной доли сантиметра. Конечно, вывести эти факты из каких-то простых принципов мы не сможем; они являются частью накопленных химиками знаний о строении молекул. Их и вспоминает химик, когда смотрит на формулу Н2O. Формула, приведенная на рис. III[238], по сравнению с формулой Н2O отражает свойства молекулы воды полнее и поэтому выглядит гораздо более содержательным символом.
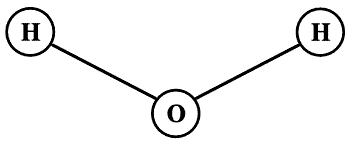
Рис. III. Модель молекулы воды, Н2O.
Но и он не совсем точен. Мы знаем, например, что каждый атом занимает определенный объем. Правда, современная физика учит, что каждый атом похож на миниатюрную солнечную систему, в которой крошечное положительно заряженное ядро окружено облаком отрицательно заряженных электронов. Казалось бы, атомы должны быть в значительной степени «пустыми». И, тем не менее, два атома не могут подойти друг к другу ближе, чем позволяют их электронные облака, поскольку между ними возникает электрическое отталкивание. На практике часто удобно считать, что атомы, как правило, ведут себя подобно твердым бильярдным шарам.
Еще один общепринятый способ изображения молекул состоит в том, что атомы на этой модели специально сделаны поменьше, чтобы можно было видеть связи между ними. Каждый атом характеризуется определенным числом связей со своими соседями; химики называют их валентными связями. По сравнению с предыдущими эти модели обладают тем преимуществом, что позволяют видеть, как выглядит молекула внутри, что особенно важно для сложных молекул. В частности, те сложные молекулы, о которых мы здесь рассказываем, очень часто изображают именно таким образом.
Итак, перед нами четыре различных способа изображения молекулы воды, и каждый из них имеет свои преимущества.
Теперь рассмотрим несколько более сложный пример. В состав природного газа входит метан, который имеет формулу СН4. Формула подсказывает химику, что в молекуле метана с одним атомом углерода связаны четыре атома водорода. Следовательно, эту молекулу можно представить таким образом:
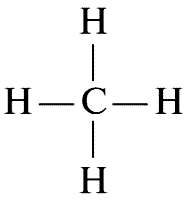
В действительности молекула метана выглядит иначе. Известно, что четыре валентные связи атома углерода не лежат в одной плоскости. Они идут в направлениях от центра тетраэдра к его вершинам. Эта модель ближе к реальности хотя бы потому, что дает нам трехмерный образ молекулы, чего обычная формула дать не в состоянии.
Допустим теперь, что мы убрали из молекул метана один атом водорода и вместо него к оставшейся СН3-группе присоединили еще такую же СН3-группу. Мы получаем молекулу СН3СН3 или С2Н6:
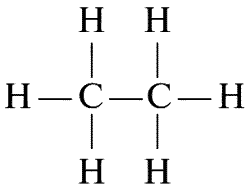
Этот этан, который, подобно метану, представляет собой газообразное соединение. Мы можем продолжать отщепление атомов водорода с заменой их на СН3-группы. Постепенно мы может построить длинную цепь атомов.
Углерод образует длинные цепи легче, чем все другие атомы, — в этом одна из причин того, что на него приходится значительная часть состава всех гигантских молекул, рассматриваемых в этой книге, и вообще большинства молекул, составляющих живые организмы. Возвращаясь к нашему примеру, мы видим, что в конце концов у нас получаются молекулы с общей формулой СН3СН2СН2… СН3. Мы можем выстроит в ряд сколько угодно СН2-групп, а затем на другом конце поместить последнюю СН3-группу, после чего будут насыщены все валентные связи:
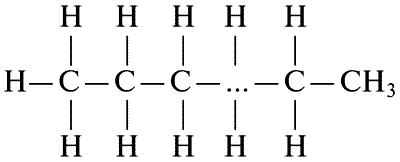
Этот тип молекул известен химикам под названием парафинов. Если такая молекула содержит только один атом углерода, мы получаем метан. Когда их станет четыре, получится бутан, которым обычно заправляют газовые зажигалки. Увеличим число атомов углерода до восьми и получим жидкий октан — он входит в состав бензина для автомобилей и самолетов. Будем так продолжать, пока не наберется уже порядочное число атомов углерода (скажем, около двадцати); тогда получим тяжелое смазочное масло. Дальнейшее добавление СН2-групп сначала даст что-нибудь вроде вазелина, и, в конце концов, очередь дойдет до твердых тел, таких, как парафин.
Как видите, по мере прибавления атомов углерода происходит постепенное изменение свойств молекул: сначала это газы, потом сильно летучие жидкости, далее жидкости становятся все более вязкими и, в конце концов, появляются твердые вещества.
Мы рассмотрели простейший из возможных примеров молекул с длинной цепью, иначе называемых полимерами. Этот пример служит наглядной иллюстрацией того, как с увеличением длины цепи постепенно изменяются свойства молекул. Можно привести много других хорошо известных примеров. Вспомним каучук и такие синтетические материалы, как нейлон и терилен, — все эти продукты также образованы длинными цепными молекулами. Если же вновь вернуться к биологии, то оказывается, что почти все гигантские молекулы, входящие в состав живых организмов, представляют собой полимеры. В частности, к ним относятся белки и нуклеиновые кислоты. К слову говоря, жиры и углеводы, которым мы в этой книге уделяем меньше внимания, построены по тому же плану. Невольно возникает вопрос: почему биологические молекулы имеют вид длинных цепей? Мы еще вернемся к этому позднее.
Надо сказать, что большие биологические молекулы, представшие теперь перед нами как длинные цепи атомов, чаще всего имеют форму, близкую к сферической. Следовательно, в большинстве случаев речь идет о компактно сложенных цепях. Очевидно, свернуть длинную цепь в плотный клубок можно многими разными способами.
Для наглядности представим себе нашу длинную молекулу в виде ожерелья из плотно нанизанных бусинок. Как легко видеть, свернуть эту нитку бус в плотный комок можно практически бесконечным числом различных способов. Поэтому, даже несмотря на то, что такие молекулы в определенном смысле линейны, понять их структуру можно только рассматривая их как трехмерные объекты. Трехмерная структура длинных цепных молекул служит предметом обсуждения следующей главы. А пока продолжим знакомство с белками, только для начала ограничимся одним измерением.
В цепях парафинов элементарным звеном — мономером — служит молекула метана СН4. В белках роль мономеров исполняют более сходные молекулы, которые химики назвали аминокислотами. Все аминокислоты различны, но в то же время между ними имеется близкое сходство (рис. IV).
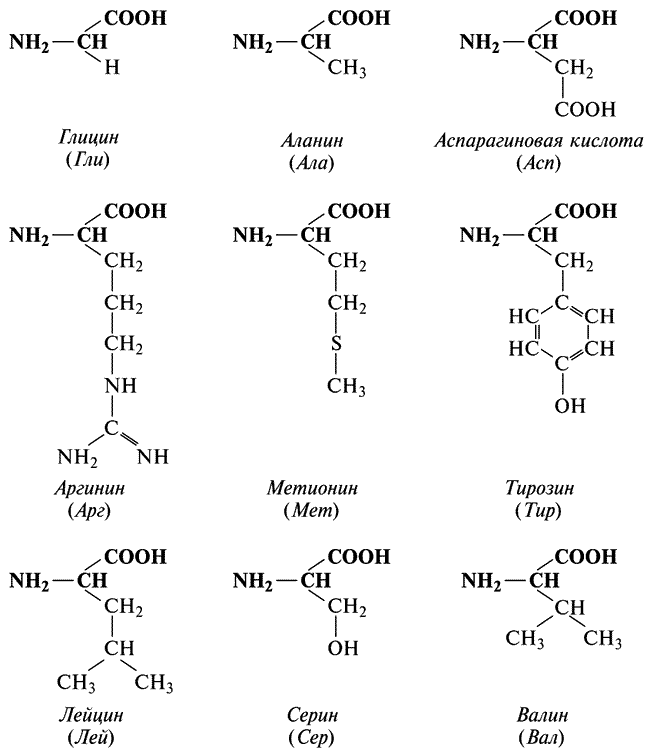
Рис. IV. Химические формулы некоторых аминокислот. На этом рисунке приведены полные и сокращенные названия аминокислот.
Легко заметить, что у всех аминокислот одна часть молекулы выглядит совершенно одинаково (на рисунке эта часть располагается вверху). Другая часть (обращена вниз) у разных аминокислот имеет совсем разный вид. Ее называют боковой цепью.
Когда аминокислоты соединяются друг с другом, каждая аминокислота теряет расположенный слева атом водорода и ОН-группу, находящуюся на ее правом конце. Свободные валентности «встречаются», аминокислоты связываются, и в результате образуется так называемая полипептидная цепь (рис. V).
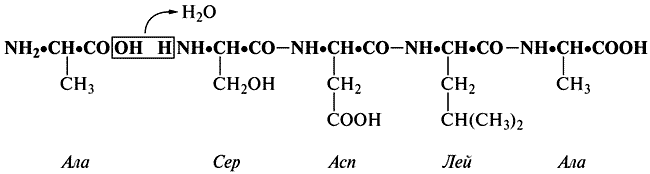
Рис. V. Образование полипептидной цепи, происходящее в результате отщепления воды от групп — СООН и — NH2 соседних аминокислот.
Атом Н и ОН-группа вместе образуют молекулу воды. Вы видите теперь, что сама цепь, или, как ее называют, главная цепь, состоит из повторяющихся элементов, число которых соответствует числу аминокислот. Это и понятно — ведь в построении цепи участвуют как раз те части молекул, которые во всех аминокислотах одинаковы. С другой стороны, боковые цепи следуют друг за другом, не повторяясь, так как разным аминокислотам соответствуют разные боковые цепи. Все это слегка напоминает браслеты с брелоками, которые иногда носят девушки. Мы можем сам браслет уподобить главной цепи, а брелоки сравнить с боковыми цепями. К длинному браслету может быть подвешено довольно много разных брелоков. В молекулах белков возможно двадцать (и только двадцать) различных сортов боковых цепей, причем данный вид боковых цепей в одной молекуле обычно встречается более одного раза, так как в общей сложности молекула белка обычно содержит по несколько сотен аминокислот.
Итак, мы знаем теперь, что белки представляют собой полимеры аминокислот, обладающие очень длинными цепями, скрепленными сотнями связей.
Пожалуй, достаточно о химии белка. Теперь давайте попробуем разобраться, почему белки так важны в биологии. Вернемся снова к последовательности химических реакций в дрожжевой клетке, о которой упоминалось в предыдущей главе. Ни одна из этих реакций в пробирке не идет, а если и идет, то очень медленно — во много раз медленнее, чем в живых организмах. Значит, в живых организмах должен присутствовать какой-то агент, ускоряющий химические реакции, заставляющий их идти во много раз быстрее, чем в пробирке. Такие агенты называются катализаторами. Возможно, вы слышали о катализаторах, которые используются в промышленности для ускорения медленно протекающих химических реакций. Подобную же роль играют катализаторы в живых организмах. Эти биологические катализаторы, называемые ферментами (от латинского слова fermentum — брожение), во многих случаях были выделены биохимиками в чистом виде. Одним из первых процессов брожения было изучено спиртовое брожение под действием дрожжей. Было установлено, что каждой отдельной реакции этого процесса соответствует свой фермент. Следовательно, только одну эту цепь реакций обслуживает около дюжины ферментов. Все эти ферменты высокоспецифичны. Каждый из них может служить катализатором только своей реакции и никакой другой. Более того, они вызывают специфическое превращение только строго определенного вида молекул. Если молекулу слегка изменить, то фермент чаще всего вообще не оказывает на нее никакого действия.
Итак, взятая нами для примера последовательность химических реакций идет при участии дюжины ферментов. Однако эти реакции составляют лишь очень малую часть всей химической активности дрожжевой клетки. И почти каждая протекающая в клетке химическая реакция идет под контролем своего специально предназначенного для нее фермента. Всего живая клетка содержит несколько тысяч разных ферментов; каждый из них осуществляет контроль над одной определенной химической реакцией, заставляя ее идти быстрее. Следовательно, ферменты представляют собой настоящий рабочий механизм живой клетки. Продолжая нашу аналогию с фабрикой, мы можем сравнить их с работающими на фабрике станками и машинами. Как видите, ферменты в клетке выполняют поистине центральную роль. Если к этому добавить, что все известные нам ферменты — белки, то станет ясно, что на пути к познанию процессов, идущих в живых организмах, нам в первую очередь необходимо понять, как устроены белки и каковы их функции в живой клетке.
Рассмотрим ряд примеров. Думаю, что многие из них читателю знакомы. Начнем, конечно, с фермента. Когда делают сыр, в молоко добавляют специальный порошок, после чего оно тут же свертывается. Этот порошок содержит фермент, который вырабатывается пищеварительным аппаратом теленка и вызывает свертывание молока. В сыроварении его называют сычужным ферментом, биохимики же называют его реннином. Другой известный белок — кератин. Мы уже говорили, что волосы состоят большей частью из белка; вот этот белок и называется кератином. Он выполняет структурную функцию. Надо сказать, что из белка построены также многие другие органы, выполняющие структурную функцию. Так, основным компонентом сухожилий, костей и кожи служит белок коллаген.
Возьмем теперь гемоглобин — белок, с которым мы не раз еще встретимся. Присутствием гемоглобина обусловлен красный цвет крови. Функция этого белка состоит в том, чтобы переносить кислород из легких к тканям. Гемоглобин обладает замечательной способностью связывать молекулярный кислород. Точнее говоря, одна молекула гемоглобина может связать одновременно четыре молекулы кислорода. В легких, где давление кислорода выше, происходит присоединение молекул кислорода к гемоглобину. Гемоглобин доставляет их к тканям, но там давление ниже, и кислород освобождается. Далее происходит диффузия кислорода внутрь клеток. В клетке молекулы кислорода встречаются с другим белком — миоглобином, о котором мы тоже еще не раз услышим. Миоглобин — это как бы младший брат гемоглобина, его молекула в четыре раза меньше и способна связывать не четыре, а только одну молекулу кислорода. Миоглобин тоже красный; этим объясняется красный цвет мяса. Молекулы кислорода переходят от гемоглобина к миоглобину, где и хранятся до тех пор, пока не потребуются клетке.
Еще один важный белок — миозин мышц, обладающий замечательным свойством — сократительностью. Именно благодаря миозиновым волокнам мышцы способны сокращаться. Механизм мышечного сокращения представляет собой одну из центральных и наиболее захватывающих проблем биологии, еще далекую от полного решения.
И последний пример: к белкам относятся некоторые гормоны — химические переносчики, предназначенные для регуляции клеточных процессов. Одним из таких белков-гормонов является инсулин.
Как видите, молекулы белков выполняют великое множество самых различных функций, хотя все они построены из одинаковых строительных блоков — все тех же двадцати аминокислот. Одни и те же строительные блоки в разных комбинациях образуют молекулы, обладающие столь разнообразными свойствами и функциями. На первый взгляд может показаться удивительным, что такое разнообразие функций возникает на основе всего лишь двадцати сортов аминокислот. Но это во всяком случае ничуть не более удивительно, чем тот факт, что из одних и тех же двадцати шести букв английского алфавита могут быть сложены и сонет Шекспира, и, скажем, книга по молекулярной биологии.
Вообще говоря, белки почти целиком состоят из аминокислот, но для большей точности отметим, что некоторые белки содержат кроме того еще и другие небольшие группы атомов. Например, в молекулах гемоглобина и миоглобина присутствуют плоские группы атомов с атомом железа в центре — так называемые гемогруппы, к которым прикрепляются молекулы кислорода. В молекуле гемоглобина таких групп четыре, а в молекуле миоглобина только одна.
Роль белков в живых клетках столь значительна, столь важна, что без преувеличения можно сказать: природа любой живой клетки определяется главным образом белками, которые она содержит. Но тогда верно и то, что природа живого организма в целом в конечном счете определяется его белками.
Следовательно, для того чтобы понять, как устроен и как работает живой организм, нам необходимо постичь природу белков и их функции в составляющих организм клетках. А если нас интересует взаимосвязь между разными организмами, то мы должны понять связь между белками, которые они содержат. Это подводит нас к проблеме видовой специфичности белков. Иначе говоря, для каждого вида характерны специфические, одному ему свойственные, молекулы белков, одинаковые у всех представителей данного вида; при этом у разных видов молекулы белка, выполняющие одни и те же функции, не идентичны.
Так, например, можно смело утверждать, что все те, кто читает эту книгу, имеют совершенно идентичный гемоглобин, абсолютно одинаковый вплоть до каждой аминокислоты, буквально до последнего атома. Очень редко, но все же случается, что у людей обнаруживается аномальный гемоглобин, однако обычно это ведет к достаточно серьезным заболеваниям, таким, например, как серповидноклеточная анемия. В таких случаях все сводится к очень простым изменениям: при серповидноклеточной анемии измененными оказываются только две из почти шестисот аминокислот, составляющих молекулу гемоглобина. Вот почему я так уверен, что у всех моих читателей молекулы гемоглобина одинаковы. Люди с аномальным гемоглобином — это, как правило, тяжелобольные, которые рано умирают; лишь самые незначительные изменения гемоглобина могут сойти для человека благополучно.
Если мы теперь обратимся к другому виду и возьмем, к примеру, гемоглобин лошади или коровы, то обнаружим, что он, казалось бы, почти ничем не отличается от гемоглобина человека. Он имеет тот же цвет, те же размеры и выполняет в организме те же функции. Однако, как показывает тонкий химический анализ, между гемоглобинами человека, лошади и коровы имеются ощутимые различия — их наборы аминокислот неодинаковы. Это мы и имели в виду, когда говорили о видовой специфичности. Может даже оказаться, что подобные различия в белках создают гораздо более глубокую основу для классификации животных и растений, чем внешние характеристики, — окраска, форма и другие признаки, которые только и имел Линней в своем распоряжении.
В следующей главе мы продолжим разговор о химии молекул белка — рассмотрим более подробно, сколько и какие именно аминокислоты составляют те или иные белки, в каком порядке они располагаются в полипептидной цепи, а также обсудим, каким образом химики научились определять последовательность аминокислот в различных белках. Однако мы вскоре увидим, что одной последовательности аминокислот нам недостаточно. Чтобы понять функции белка, необходимо точно знать способ свертывания полипептидной цепи в плотный клубок. Мы узнаем далее, как здесь на помощь химикам пришли физики, разработавшие специальные методы для изучения больших молекул не в одном, а в трех измерениях.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК